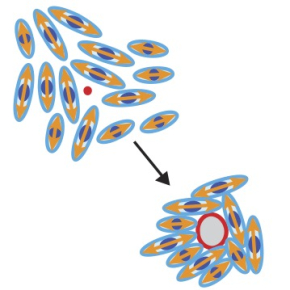
L'intégrité du tissu épithélial à l'épreuve des contraintes mécaniques
Publié dans Nature Physics, ce travail montre que des tissus épithéliaux peuvent se fracturer spontanément du fait de la capacité des cellules à se déformer et à migrer. Le modèle physique, qui relie la qualité de l’adhésion entre cellules à celle existant avec leur environnement, explique l’apparition de fractures localisées au niveau de certains motifs cellulaires, qui favorisent l’émergence d’une tension mécanique maximale.
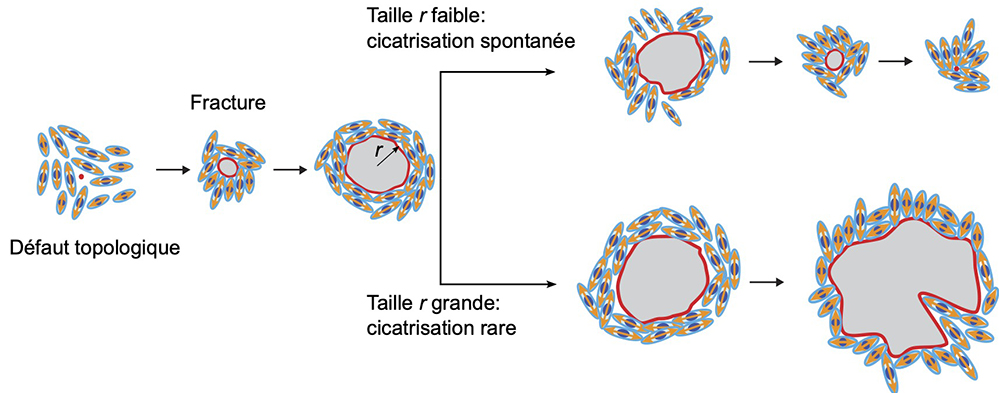
Présents dans tout l’organisme et quasiment dans tous les organes, les tissus épithéliaux sont constitués de fines couches de cellules étroitement liées les unes aux autres. Assurant des fonctions de protection et de barrière, ces tissus sont soumis à de nombreux stress environnementaux. Afin de répondre à ceux-ci, les tissus subissent des modifications morphologiques parmi lesquelles l’apparition de fractures et trous, que l’on trouve associés dans certaines pathologies oculaires ou pulmonaires (asthme). Ce travail propose un mécanisme physique pour expliquer la formation de trous dans les tissus épithéliaux.
Afin de suivre les réponses mécaniques des tissus épithéliaux sur des substrats de différentes rigidités, les scientifiques ont développé pour cette étude des hydrogels mous, d’une rigidité dix fois inférieure aux gels existants se rapprochant de celle observée dans les tissus graisseux. Cultivées sur ces gels mous, les cellules se divisent jusqu’à former un tissu fin et dense d’une cellule d’épaisseur. A la surprise des scientifiques, une fois le tissu formé et que les cellules continuent de se diviser, des fractures apparaissent et disparaissent spontanément. Pour mieux comprendre l’origine de ces fractures, les scientifiques ont utilisé un système expérimental qui permet de mesurer l’état de tension du tissu. Ils ont montré que, sur ces nouveaux gels mous, le tissu est bien sous forte tension mécanique. A l’inverse, sur les gels plus rigides, le tissu est faiblement tendu et les trous sont rares. A l’échelle cellulaire, deux types de cellules sont à l’origine des trous, d’une part les cellules en cours de division et d’autre part celles qui sont très étirées.
A l’échelle multi-cellulaire, deux types de motifs sont à l’œuvre, associés aux formes cellulaires. Spontanément, les cellules se déforment, s’étirent et dessinent collectivement des motifs en forme de comètes et trèfles, appelés défauts topologiques. Ces motifs apparaissent de manière générique dans toutes les assemblées d’objets de forme allongée (bâtonnet, chaîne de polymère, etc.). La physique de ces assemblées est connue sous le nom de théorie des cristaux liquides. En adaptant cette théorie, les chercheurs expliquent l’apparition de fortes fluctuations locales du niveau de tension mécanique. Lorsqu’elles sont positives, ces fluctuations favorisent la formation des trous, et à l’inverse, lorsqu’elles sont négatives, contribuent à leur cicatrisation spontanée.
Ce travail ouvre des perspectives nouvelles sur le rôle de la tension mécanique dans la régulation physiologique des tissus épithéliaux.
Pour en savoir plus :
Mechanical stress driven by rigidity sensing governs epithelial stability.
S.-Z. Lin, Y. M. Y. Ivan, I. Pi-Jauma, C. Jebane, M. Karnat, Y. Toyama, P. Marcq, J. Prost, R.-M. Mège, J.-F. Rupprecht, B. Ladoux
Nat. Phys. (2022). DOI : https://doi.org/10.1038/s41567-022-01826-2
Contact
Laboratoires
Centre de physique théorique (CNRS/Université Aix-Marseille)
Campus de Luminy
163 avenue de Luminy
13009 Marseille cedex
Institut Jacques Monod (Université Paris Cité/CNRS)
15 rue Hélène Brion
75205 Paris cedex 13