Thomas LecuitEnseignant-chercheur
Enseignant-chercheur à l'Institut de biologie du développement de Marseille (IBDM)1
Thomas Lecuit travaille sur l’origine des formes dans le vivant, comme celle d’un neurone ou d’un embryon. Au cours de l'embryogenèse, des millions de cellules se divisent, se déplacent, changent de forme et collectivement donnent naissance à un organisme complexe. Quelles sont les forces mécaniques en jeu, et quels flux d’information guident ces processus complexes vers leur terme ? Pour répondre à ces questions, il dirige une équipe interdisciplinaire qui observe, caractérise et perturbe par des approches expérimentales les propriétés physiques et biologiques du développement de la drosophile, et développe en collaboration avec des physiciens des approches théoriques et de modélisation. Il est directeur du Centre Turing pour les systèmes vivants (CENTURI). Il est membre de l'Académie des sciences, l'Academia Europaea et membre élu de EMBO. Il est aussi lauréat du prix Liliane Bettencourt pour les sciences de la vie (2015) et la médaille d'argent du CNRS (2015).
Projet GeoMorpho (Horizon Europe - ERC AdG 101200010)
Contraintes et rétroactions géométriques au cours de la morphogenèse
Durant le développement, les mouvements cellulaires et les modifications de forme donnent naissance à des architectures complexes. Quels principes assurent la fidélité de la morphogenèse ? Jusqu'à présent, les recherches se sont concentrées sur le rôle des gènes et de la mécanique locale dans les changements cellulaires et la morphogenèse tissulaire. Cependant, les propriétés géométriques des tissus (taille, dimensionalité, courbure, forme globale) et leurs contraintes physiques apparaissent désormais comme des éléments clés, longtemps négligés, de ce processus.
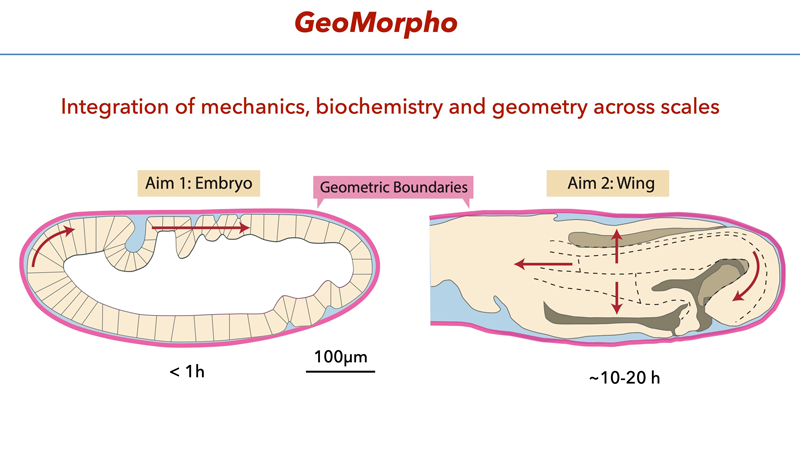
Ce projet interdisciplinaire élucidera comment la géométrie et ses rétroactions influencent la mécanique cellulaire et contribuent à la morphogenèse. L’interaction entre géométrie et processus mécanochimiques actifs sera étudiée dans deux systèmes où des limites physiques guident la morphogenèse : chez l’embryon de drosophile, l’écoulement tissulaire polarisé et une vague morphogénétique d’invagination dépendent des interactions avec la membrane vitelline qui entoure l’embryon. Cette enveloppe impose une courbure, sert de substrat adhésif rigide, et confine la diffusion de molécules dans le liquide extra-embryonnaire.
Lors de la métamorphose de la pupe2 , la formation de l’aile implique une expansion tissulaire spectaculaire à l’intérieur d’un sac pupaldimensionnalité rigide, forçant un emballage complexe tout en préservant la planéité de l’aile adulte. La dynamique des flux tissulaires, l’expansion et le plissement sous contraintes restent à caractériser. Ces deux systèmes partagent des similitudes : déformations 3D pilotées par des contraintes actives internes et des limites externes rigides.
L’objectif de ce projet est de décrypter :
- Les processus mécanochimiques responsables des déformations tissulaires.
- L’impact des contraintes géométriques sur la mécanique cellulaire et tissulaire.
Ce projet révélera ainsi comment la forme des tissus influence les mécanismes qui génèrent cette forme.